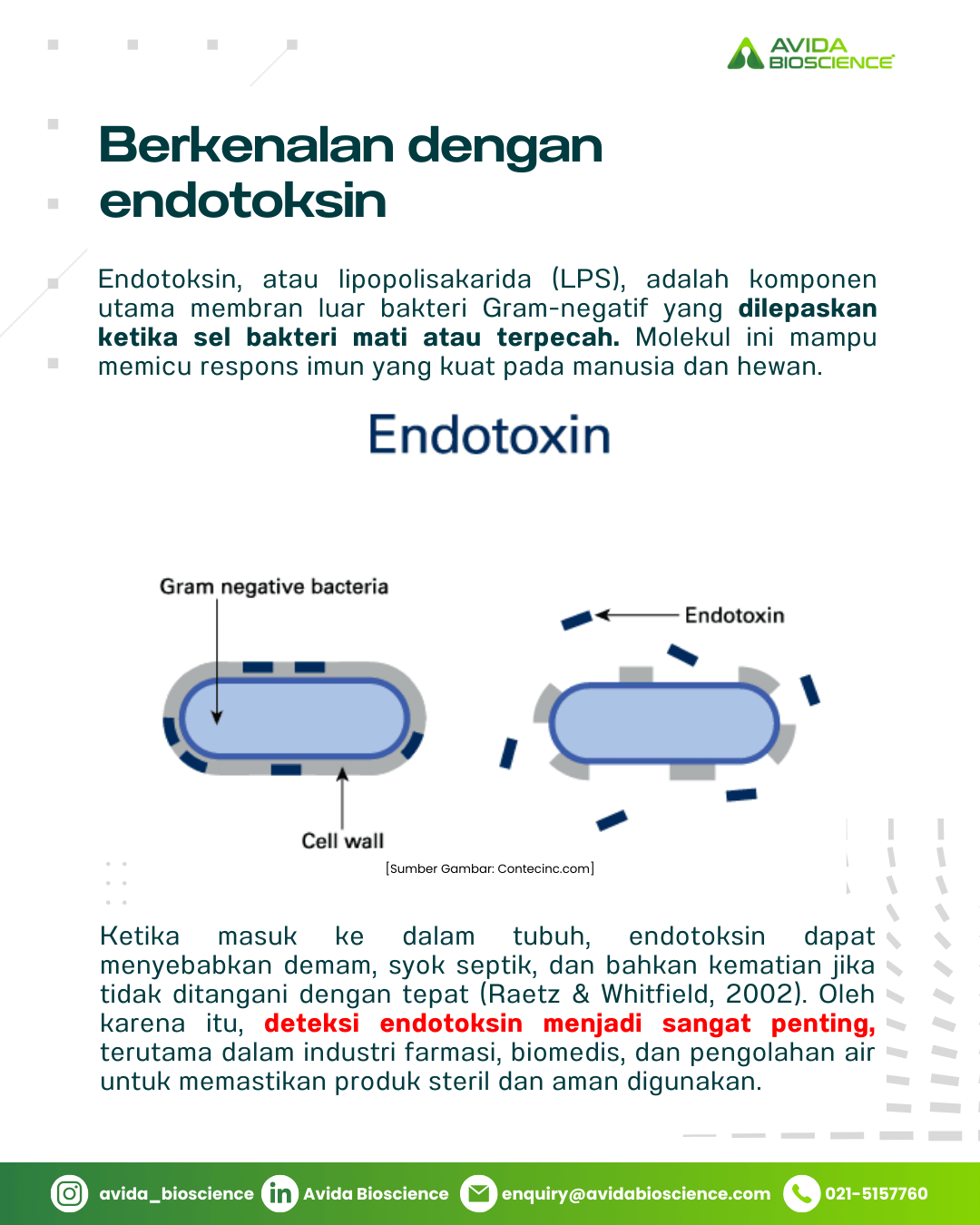
Endotoksin, atau lipopolisakarida (LPS), adalah komponen utama membran luar bakteri Gram-negatif yang dilepaskan ketika sel bakteri mati atau terpecah. Molekul ini memiliki peran penting dalam patogenesis infeksi bakteri karena kemampuannya memicu respons imun yang kuat pada manusia dan hewan.
Ketika masuk ke dalam tubuh, endotoksin dapat menyebabkan demam, syok septik, dan bahkan kematian jika tidak ditangani dengan tepat (Raetz & Whitfield, 2002). Oleh karena itu, deteksi endotoksin menjadi sangat penting, terutama dalam industri farmasi, biomedis, dan pengolahan air untuk memastikan produk steril dan aman digunakan.
Perkembangan Metode Deteksi Endotoksin
Deteksi endotoksin telah mengalami transformasi signifikan sejak pertama kali ditemukan. Pada awalnya, metode deteksi endotoksin didasarkan pada tes in vivo menggunakan kelinci, di mana peningkatan suhu tubuh kelinci digunakan sebagai indikator adanya endotoksin. Namun, metode ini dinilai kurang sensitif, mahal, dan menimbulkan isu etika terkait penggunaan hewan percobaan (Ding & Ho, 2001).
Pada tahun 1960-an, metode Limulus Amebocyte Lysate (LAL) diperkenalkan sebagai alternatif yang lebih efisien dan sensitif. LAL berasal dari darah kepiting tapal kuda (Limulus polyphemus ), yang mengandung protein yang dapat membentuk gel saat bereaksi dengan endotoksin. Metode ini menjadi standar emas dalam deteksi endotoksin selama beberapa dekade karena kemampuannya mendeteksi kadar endotoksin yang sangat rendah, yaitu dalam orde pikogram per mililiter (pg/mL) (Obayashi et al., 1985).
Namun, meskipun LAL sangat efektif, metode ini memiliki beberapa kelemahan. Salah satu tantangan utama adalah dampak ekologisnya terhadap populasi kepiting tapal kuda. Pengambilan darah secara berlebihan dari spesies ini telah menyebabkan penurunan populasi yang signifikan, sehingga memunculkan kekhawatiran tentang keberlanjutan metode ini (Krisfalusi-Gannon et al., 2018). Selain itu, harga reagen LAL yang relatif mahal dan variabilitas hasil akibat kontaminasi non-endotoksin juga menjadi faktor pendorong pencarian alternatif.
Transisi ke Recombinant Factor C (rFC)
Seiring perkembangan teknologi rekayasa genetika, metode baru berbasis recombinant factor C (rFC) mulai mendapatkan perhatian. rFC adalah protein rekombinan yang diproduksi melalui ekspresi gen factor C, sebuah komponen utama dalam jalur koagulasi LAL. Protein ini bekerja dengan cara mengkatalisis substrat fluoresen atau kromogeniknya secara langsung tanpa memerlukan komponen tambahan lainnya (Ding et al., 2000).
Keunggulan utama rFC dibandingkan LAL adalah sifatnya yang lebih ramah lingkungan karena tidak bergantung pada ekstraksi darah kepiting tapal kuda. Selain itu, rFC menunjukkan tingkat sensitivitas dan spesifisitas yang setara atau bahkan lebih baik dibandingkan LAL, dengan tingkat variabilitas yang lebih rendah (Bolden et al., 2020). Hal ini membuat rFC menjadi pilihan yang lebih menjanjikan untuk aplikasi modern, termasuk dalam pengujian obat-obatan, vaksin, dan perangkat medis.
Regulator internasional seperti European Pharmacopoeia dan United States Pharmacopeia (USP) telah mulai menerima penggunaan rFC sebagai metode alternatif yang valid untuk deteksi endotoksin. Beberapa perusahaan farmasi besar bahkan telah beralih sepenuhnya ke rFC untuk memenuhi standar keberlanjutan dan efisiensi operasional (Hartung, 2015).
Mengapa Penting untuk Beralih?
Selain alasan keberlanjutan, penggunaan rFC juga memberikan manfaat dalam hal stabilitas dan reproduktibilitas data. Dalam era globalisasi dan peningkatan permintaan akan produk steril, metode yang lebih stabil dan dapat diskalakan seperti rFC menjadi semakin relevan. Selain itu, penggunaan teknologi rekombinan ini membuka peluang untuk pengembangan metode deteksi endotoksin yang lebih inovatif di masa depan, seperti integrasi dengan platform biosensor atau sistem otomatisasi.
Kesimpulan
Endotoksin tetap menjadi ancaman serius dalam berbagai aplikasi biomedis dan industri. Evolusi metode deteksi endotoksin, dari tes kelinci hingga LAL, dan kini menuju rFC, mencerminkan kemajuan ilmiah yang signifikan serta kesadaran akan keberlanjutan lingkungan. Penggunaan rFC tidak hanya menawarkan solusi yang lebih ramah lingkungan, tetapi juga meningkatkan presisi dan efisiensi dalam pengujian endotoksin. Dengan dukungan regulator dan industri, rFC berpotensi menjadi standar baru dalam deteksi endotoksin di masa depan.
Referensi
- Raetz, C. R. H., & Whitfield, C. (2002). Lipopolysaccharide endotoxins.Annual Review of Biochemistry, 71, 635–700.
- Ding, J. L., & Ho, B. (2001). A new era in pyrogen testing.Trends in Biotechnology, 19(8), 277–281.
- Obayashi, T., Tamura, H., Tanaka, S., & Suzuki, T. (1985). Limulus test using toluidine blue for detecting bacterial endotoxins.Journal of Clinical Microbiology, 22(1), 160–162.
- Krisfalusi-Gannon, J., Wale, K., Dellinger, K., & Goddard, M. K. (2018). The role of horseshoe crabs in the biomedical industry and recent trends impacting species sustainability.Frontiers in Marine Science, 5, 185.
- Bolden, J. S., Smith, K. E., & Jones, R. D. (2020). Recombinant factor C: An alternative to the LAL assay for endotoxin detection.Biologicals, 64, 1–8.
- Hartung, T. (2015). Food for thought… on alternative methods for LAL-based endotoxin testing.ALTEX, 32(3), 175–182.
- Ding, J. L., Navas, M. A., & Ho, B. (2000). Molecular cloning and characterization of a cDNA encoding prophenoloxidase activating factor from the crab Scylla serrata.Journal of Biological Chemistry, 275(31), 24109–24115.
Untuk informasi lebih lanjut, hubungi tim kami di AVIDA Bioscience!